Nature:尽早使用大 Panel 检测以期更好的临床获益
NGS 技术助力肿瘤患者精准用药
肿瘤 NGS 检测的未来发展方向一定是从小 Panel 到大 Panel,临床药效的分子标记物将不再局限于单基因、单位点,包含更多基因和位点的 NGS 大 Panel 将是未来分子检测项目的发展趋势。NGS 大 Panel 普遍具备以下特点:覆盖的癌种类型广,涵盖的相关基因及其变异形式多,提供的临床诊治建议及其功效提示全。
OncoDiTM 是凡迪基因于 2019 年正式推出的泛癌种基因检测项目:包含 OncoDiTM160 和 OncoDiTM375 两款 Panel。其中 OncoDiTM375 大 Panel 采用高通量测序技术检测 375 个基因的 DNA 序列变异,涉及 3318 个区段,包含 1372 个单碱基变异 / 短片段插入和缺失,342 个外显子,23 个融合热区以及 10 个全基因区域。此外,OncoDiTM375 大 Panel 测序范围还包括 NCCN 指南推荐的 7 个重要融合基因全基因区域,检测结果包含覆盖范围内的所有突变类型(点突变、插入缺失突变、拷贝数变异以及融合突变),从而有机结合常见和罕见驱动基因突变,同时提供错配修复(MMR)相关基因状态和肿瘤突变负荷(TMB)等信息,最大化临床获益。
具有以下几个产品特点:
一、以药物为中心的产品设计
OncoDiTM375 产品以肿瘤精准用药为核心设计,以药物可及性为目的,涵盖全部癌种的用药信息包括 82 种靶向药(已纳入中国医保的 39 种,获得 NMPA 批准的 9 种和获得 FDA 批准的 34 种)及 39 种化疗药(已纳入中国医保的 37 种和获得 FDA 批准的 2 种)覆盖了市场上 98% 的靶向和化疗药物,真正让患者有药可及。
二、2.5Mb 超大靶区覆盖
OncoDiTM375 产品覆盖 2.5Mb 的靶区范围,远高于行业同类产品。其中对基因融合区域专门设计捕获探针,重点覆盖共 25 个融合基因,其中包括 7 个关键融合基因(ALK/ROS1/MET/RET/NTRK1/NTRK2/NTRK3)的全基因区和 18 个其他常见融合基因的热点区域,可以一次性检测常见及罕见融合伴侣,提高了融合基因的检出率。
三、兼容液体活检单分子序列标签技术(UMI)技术
OncoDiTM 采用双端双链分子标签技术,结合凡迪自有的 40 万例样本降噪基线数据库可以极大程度降低外周血中低频噪音干扰,提高了检出灵敏度和特异性。
四、超大测序数据量
OncoDiTM 产品一直采用超大测序数据量,为检测准确性提供有力的支撑与保障。
五、TMB 评估
OncoDiTM375 大 Panel 包含 375 个基因,2.5Mb 的靶区,可以精准预测 TMB。
凡迪基因 秉持 “以客户健康为中心”的企业精神,每一天,我们都在尽我们所能,追踪全球癌症治疗进展,为每一位接受检测服务的中国患者以及医生推荐精准的癌症个性化用药解决方案,让中国患 者没有难治的癌症!
肿瘤是一类具有很大异质性的疾病,很少由单一的基因驱动,通常合并有多种突变丰度不同的驱动基因。I-PREDICT 研究采用大 Panel 对经治、难治性晚期肿瘤患者进行分子检测,并进行个体化的联合治疗。研究中 88% 的患者根据分子突变谱接受了个体化,≥1 个分子匹配治疗,可见联合治疗增加了个体化治疗人群,可以使更多的患者获益。
研究证实在临床实践中,基于大 Panel 分析所得的分子信息对晚期难治性肿瘤患者进行个体化联合治疗方案是可行的,为未来的肿瘤治疗提供了一个新的思路和方向,也提示我们应该尽早的使用大 Panel 检测,并综合分子检测结果,尝试个体化的联合治疗模式,应对肿瘤的复杂性和异质性,以期取得更好的临床获益。
肿瘤是一类非常复杂,具有广泛异质性的疾病。既往根据单一驱动基因突变匹配单一分子靶向治疗的模式,很容易出现复发耐药,而根据每个患者的分子突变谱进行个体化的联合治疗可能是未来的方向。
近日,Nature Medicine 上发表了一项前瞻性非随机 I -PREDICT 研究,该研究探索了根据多基因检测结果为晚期癌症患者制定个体化联合治疗方案的可行性。
I-PREDICT 研究是一项在两个中心(加州大学圣地亚哥分校摩尔斯癌症中心和南达科他州 Sioux Falls 苏福尔斯大学 Avera 癌症研究所)开展的前瞻性导航试验,旨在评估根据晚期恶性肿瘤患者分子谱,及时推荐个体化联合治疗的可行性。
研究对所有符合条件且签署知情同意的患者均进行二代测序。此外,还尽可能的进行 PD-L1 的检测、分析 MSI、TMB 结果。基于上述基因检测信息,为患者匹配个性化的联合治疗。
研究中共 149 例经治、难治性晚期肿瘤患者参加了 I -PREDICT 研究,其中 83 例(56%)患者可进行分析。
在这 83 例接受治疗的患者中,73 例(88%)患者根据分子突变谱接受了个体化治疗:73 例患者中 67 例(91.8%)患者接受了分子靶向治疗,14 例(19.1%)患者根据 PD-L1 阳性、高 / 中等 TMB、MSI-H、CD274(PD-L1)扩增或携带≥8 个基因变异(PD-L1 表达状态、TMB 和 MSI 状态未知)接受免疫检查点抑制剂(单药或联合其他药物)治疗;4 例(5.5%)患者基于激素受体阳性表达接受激素治疗联合靶向治疗。
研究通过“匹配分数”系统对所有患者进行分层(“匹配分数”系统:与后续用药相匹配的分子变异总数,除以基因异常总数),将匹配分数>50% 的患者定义为高匹配患者(N=28),匹配分数≤50% 者定义为低匹配患者(N=55),未匹配靶向治疗的患者定义为匹配分数 =0%(N=10)。高匹配患者接受的治疗方案中,药物种类中位数为 2 种(范围 1~5 种);低匹配患者接受的治疗方案中药物种类中位数也是 2 种(范围 1~4 种)。
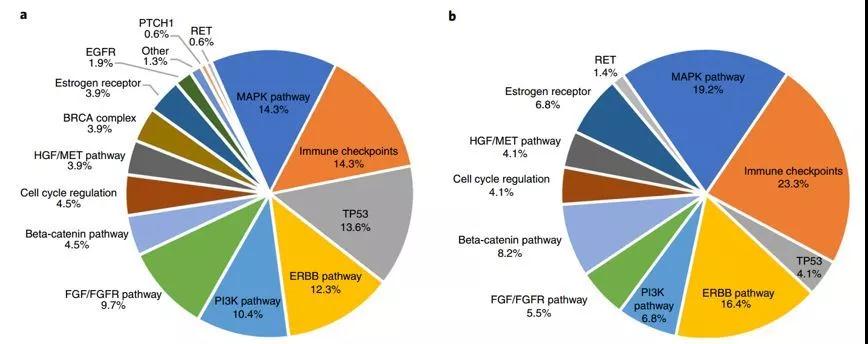
图 1.(a)接受至少一种匹配药物治疗的 73 例患者在特定靶点或通路中可干预变异百分比;
(b)28 例匹配分数为>50% 的患者在特定靶点或通路中可干预变异百分比
所有患者随访直至疾病进展或治疗不可耐受或死亡。中位随访时间为 10.8 个月。总体而言,可评估疗效的患者中,30% 取得了疾病控制:包括疾病稳定≥6 个月(N=4)、完全缓解(N=1)、部分缓解(N=16)。
研究中患者的匹配率高达 49%(79/149),远超过其他已知的精准治疗研究。
研究者认为研究使用癌症相关的大 Panel 高通量平行测序对患者进行分子检测,同时尽可能的进行 TMB、MSI 状态、PD-L1 表达和 ctDNA 检测,一次性获得肿瘤患者的分子全景信息是得到高匹配率的关键原因之一。
参考文献
ason K. Sicklick, Shumei Kato, Ryosuke Okamura, et al. Molecular profiling of cancer patients enables personalized combination therapy: the I-PREDICT study. Nat Med. 2019,(2019-04-22)[2019-05-06].